
|
Toksyna botulinowa
W jaki sposób działa botulina?
Ze względu na swoje właściwości toksyna zaliczana jest do egzotoksyn. Tym niemniej różni się od typowych egzotoksyn, tym, że nie jest wydzielana na zewnątrz podczas wzrostu bakterii. Syntetyzowana toksyna gromadzona jest wewnątrz komórek, a dopiero po ich śmierci i autolizie uwalniana w kompleksie z hemaglutyniną.
Od niedawna wiadomo, że toksyna botulinowa może być również wytwarzana przez niektóre szczepy Clostridium baratii i Clostridium butyricum.
Istnieje osiem serotypów toksyn: A, B, C1, C2, D, E, F i G, z których bakterie C. botulinum wytwarzają toksynu serotypu A, B, C i D. Dotychczas u człowieka stwierdzono zatrucia toksynami typu A (jest ich najwięcej), B, E i F.
Egzotoksyna botulinowa jest białkiem złożonym z dwóch połączonych mostkiem dwusiarczkowym łańcuchów polipetydowych: ciężkiego (100 kDa) i lekkiego (50 kDa). (W obecnej nomenklaturze łańcuch ciężki stanowi podjednostkę B, a lekki podjednostkę A - budowa toksyn). Aby nabyć swoje wiruletne właściwości neurotoksyna uwolniona przez bakterie w nieaktywnej postaci, musi ulec proteolizie, którą katalizują albo bakteryjne proteazy albo enzymy proteolityczne wydzielane przez żołądek. Zabsorbowana przez śluzówkę botulina przenika do krwiobiegu i wraz z krwią dostaje się do obwodowych zakończeń nerwowych. Tam blokuje przepływ sygnałów w cholinergicznych synapsach nerowo-mięśniowych (w których przekaźnikiem jest acetylocholina). 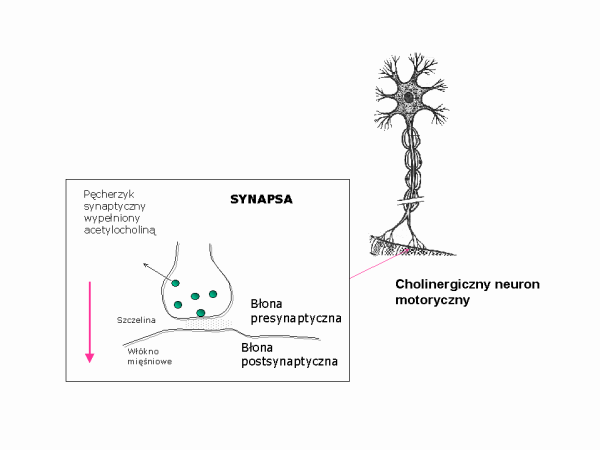
Łańcuch ciężki toksyny odpowiedzialny jest za swoiste związanie się z błoną neuronów motorycznych i za wprowadzenie łańcucha lekkiego do wnętrza neuronu na drodze endocytozy. Łańcuch lekki posiada aktywność enzymatyczną. Jest zależną od cynku endopeptydazą, która trawi białka SNARE (soluble NSF-attachment protein receptor) odpowiedzialne za fuzję pęcherzyka synaptycznego wypełnionego neuromediatorem z błoną neuronu. Nie może dojść wówczas do uwolnienia acetylocholiny do szczeliny synaptycznej i skurczu włókien mięśniowych. W konsekwencji prowadzi to do porażenia i zwiotczenia mięśni. Śmierć następuje zwykle w wyniku paraliżu mięśni oddechowych i zatrzymania akcji serca.
Poznane serotypy toksyn różnią się nie tylko właściwościami antygenowymi, ale także specyficznością wobec substratu - trawią inne białka SNARE. Neurotoksyna typu A, C, E działa na białko SNAP-25, typ B, D, F, G trawi synaptobrewinę, a typ C - syntaksynę. Warto tu dodać, że inna neurotoksyna wytwarzana przez bakterie z rodzaju Clostridium - toksyna tężcowa - jest również cynkową endopeptydazą, która inaktywuje białka SNARE. Działa ona jednak na neurony centralnego układu nerwowego i uniemożliwia uwalnianie mediatorów hamujących: kwasu gamma-aminomasłowego i glicyny.
Na podstawie badań z naczelnymi określono w przybliżeniu śmiertelną dawkę toksyny botulinowej dla człowieka. W przypadku osoby o wadze 70 kg wynosi ona około:
Na szczęście toksyna jest wrażliwa na działanie wysokiej temperatury: inaktywuje ją gotowanie przez 1 minutę bądź pogrzanie do temp. 85oC przez 5-10 minut. Zinaktywowana termicznie, niezjadliwa toksyna nosi nazwę toksoidu lub anatoksyny.
Zastosowanie toksyny w leczeniu i kosmetyce
Dzięki właściwości zwiotczania mięśni botulina znalazła swoje zastosowanie w leczeniu niektórych zaburzeń neurologicznych.
Niedawno wprowadzono botulinę także do kosmetyki. Niewielkie dawki toksyny paraliżują niektóre mięśnie twarzy wygładzając zmarszczki. Należy jednak pamietać, że wstrzykiwanie toksyny prowadzi do trwałego uszkodzenia mięśni twarzy.
Strona 1 | Strona 2 | Strona 3 | | Szukaj