
|
Innym, istotnym czynnikiem wirulencji jest egzotoksyna.
Jej istnienie zaobserwowano dopiero w latach 50. zeszłego wieku, ponieważ bakterie hodowane in vitro uwalniają ją przez bardzo krótki okres czasu. Egzotoksyna składa się z trzech białkowych komponent, z których żadna działając pojedynczo nie wykazuje zjadliwości. Są to białka EF (edema factor), PA (protective antigen) i LF (lethal factor).Czynnik EF w połączeniu z białkiem PA tworzy toksynę EdTx, która wywołuje opuchliznę. Z kolei, wstrzyknięcie zwierzętom czynnika LF w połączeniu z PA - toksyny określanej jako LeTX - prowadzi do śmierci. Jak już wspomniano, geny kodujące te składniki - odpowiednio: pagA, cya, lef - znajdują się na plazmidzie pXO1. Tę informację uzyskano z kolei niecałe 20 lat temu.
Jak działa egzotoksyna?
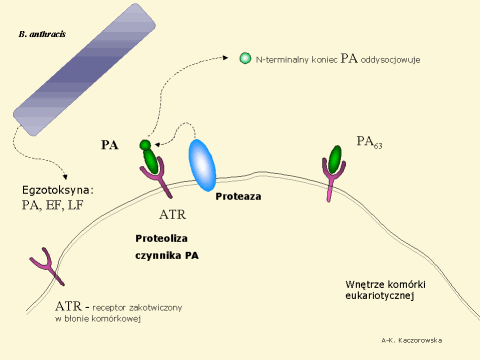
Białko PA wiąże się z receptorami ATR (anthrax toxin receptor) obecnymi na powierzchni komórki umożliwiając tym samym wejście czynników EF i LF do jej wnętrza. Dzieje się to w ten sposób, że po związaniu się receptorem ATR, białko PA trawione jest przez komórkową proteazę (furyna), a powstały C-terminalny fragment PA (63 kDa) uzyskuje zdolność do polimeryzacji i tworzy heptamer. Wówczas następuje związanie czynnika LF lub EF i kompleks PA-EF (lub PA-LF) wprowadzony zostaje do komórki na drodze endocytozy (zobacz schemat ponizej).
Związanie się PA z receptorem i proteoliza | Polimeryzacja PA i związanie czynnika EF | Translokacja EF do cytozolu | Cała sekwencja wydarzeń
Na podstawie artykułu Mourez i in. z Nat Biotechnol 2001 Oct;19(10):958-61
W normalnej sytuacji pochłonięte na drodze endocytozy cząsteczki zostałyby stopniowo zdegradowane przez komórkowe proteazy w specjalnych pęcherzykach endosomalnych (wczesne endosomy, późne endosomy; lizosomy), a powstałe fragmenty peptydowe byłyby prezentowane przez cząsteczki głównego układu zgodności tkankowej (MHC) na powierzchni komórki (to w dużym skrócie myślowym). W przypadku toksyny B. anthracis nie dochodzi do jej degradacji, gdyż kwaśny odczyn pH w endosomie indukuje wbudowanie się heptameru PA w błonę endosomu i translokację czynnika EF do cytozolu. (Podobnie do komórki zostaje wprowadzone białko LF).
Składniki toksyny B. anthracis mają zastosowanie w badaniach naukowych. Niezwykłą właściwość czynnika PA - wprowadzenie fuzyjnych białek do wnętrza komórki - wykorzystano do prezentacji antygenów wirusowych przez cząsteczki głównego kompleksu zgodności tkankowej MHC klasy I, które obecne są na powierzchni jądrzastych komórek ssaczych. Stwarza to możliwość studiowania in vitro funkcji limfocytów T cytotoksycznych oraz podstawy do opracowywania nowych szczepionek, które stymulowałyby odpowiedź immunologiczną typu komórkowego. Badania takie prowadzi się już w przypadku szczepionek skierowanych przeciw wirusom zapalenia wątroby typu C (HCV) oraz HIV.
Strona 1 | Strona 2 | Strona 3 | Strona 4 | Szukaj